
Как AR Book совершенствует учебный процесс
AR Book — это прогрессивная система, которая воплощает самые современные технологии в сфере образования, внося радикальные изменения в методы обучения и оценки благодаря виртуальной реальности.

Megogo запускает новый раздел — Образование
В нем собраны более 1000+ лекций онлайн-школ и институтов для детей и взрослых. Сейчас пользователям предлагаются четыре основные темы: IT, бизнес и креатив, Образование для детей, Английский язык и Саморазвитие.
Состояние изучаемого вопроса в современной российской школе

Алгоритм 7. Вычисление теплоты образования вещества

Задача. При сжигании 93 г белого фосфора выделилось 2322 кДж теплоты. Рассчитайте теплоту образования оксида фосфора(V).
Алгоритм 8. Вычисление теплового эффекта реакции по закону Гесса
Задача. Вычислите тепловой эффект реакции
Fe2O3 + 2Al ![]() Al2O3 + 2Fe,
Al2O3 + 2Fe,
если теплота образования оксида железа(III) составляет +821,5 кДж/моль, а теплота образования оксида алюминия +1675,7 кДж/моль (теплота образования простого вещества равна нулю).

Задания для самоконтроля
1. Составьте термохимическое уравнение реакции разложения карбоната кальция, если при разложении 40 г карбоната кальция поглощается 70,8 кДж теплоты.
Ответ. CaCO3 = CaO + CO2![]() – 177 кДж/моль.
– 177 кДж/моль.
2. Сколько теплоты выделится при полном сгорании 1 м3 смеси, состоящей из 30% (по объему) этилена и 70% ацетилена, если при сгорании 1 моль этих веществ выделяется соответственно 1400 и 1305 кДж?
Ответ. 59 531 кДж.
3. Вычислите теплоту сгорания ацетилена С2Н2, если теплота образования углекислого газа 393,5 кДж/моль, водяного пара – 242 кДж/моль, ацетилена – 226,8 кДж/моль.
Ответ. 1604,4 кДж.
Химическое равновесие
Необратимых реакций нет, любой процесс, рассматриваемый как необратимый, может быть превращен в обратимый (и наоборот). Разложение карбоната кальция:
![]()
Реакция необратима, если она осуществляется в открытой системе (т. е. где из сферы реакции возможно улетучивание оксида углерода(IV)). Однако в замкнутой системе процесс идет не полностью. Когда в системе устанавливается определенное давление газа, препятствующее разложению, процесс становится обратимым. Для обратимой реакции, записываемой в общем виде:
aA + bB = cC + dD,
скорость прямой реакции uпр определяется из соотношения:
![]()
где k1 – константа скорости прямой реакции, cA и cB – молярные концентрации веществ А и В. Концентрации веществ А и В уменьшаются, и, следовательно, скорость прямой реакции понижается. Появление в системе продуктов С и D означает возможность протекания обратного процесса, скорость которого uобр математически выражается следующим образом:
![]()
По мере накопления в системе веществ С и D скорость обратного процесса непрерывно возрастает до выравнивания скоростей прямой и обратной реакций: uпр = uобр. Подобное состояние системы называется химическим равновесием. Соотношение между концентрациями при равновесии выражается формулой:
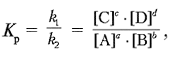
где Kp – константа равновесия, [A], [B], [C], [D] – равновесные концентрации веществ. Величина константы химического равновесия зависит от природы реагирующих веществ и от температуры. Если Kp > 1, то uпр > uобр, если Kp < 1, то uпр < uобр. Смещение равновесия в зависимости от изменения условий определяется универсальным принципом Ле Шателье: если на систему, находящуюся в состоянии химического равновесия, оказывать воздействие, выражающееся в изменении концентрации, температуры или давления, то равновесие смещается в направлении, способствующем ослаблению этого воздействия.
Пример 1. Почему лакмус (HInd) в кислой среде (избыток H3О+) – красный, а в щелочной (избыток гидратированного ОН–, рН > 7) – cиний?
Решение
Уравнение диссоциации индикатора можно представить в виде:
HInd ![]() Н+ + Ind–.
Н+ + Ind–.
В состоянии химического равновесия:
![]()
1) При избытке в растворе гидратированного Н+ (кислая среда, рН < 7) Кр < 1. Химическое равновесие сдвигается в сторону обратной реакции, т. е. в растворе накапливаются недиссоциированные молекулы индикатора красного цвета.
2) Избыток ОН– (щелочная среда, рН > 7) нейтрализует ионы гидроксония, т. е. уменьшает их концентрацию, что сдвигает равновесие вправо (Кр > 1), в сторону накапливания гидратированных анионов индикатора синего цвета Ind–.
Более подробно о учебе:
Организация самостоятельной работы учащихся на уроках
экономики в школе
Самостоятельная работа представляет особый вид любой учебной деятельности учащихся, осуществляемой под руководством, но без непосредственного участия учителя. Самостояте ...
«Элитарные» и «трудовые» школы
Основная функция учреждений образования – обеспечение процесса воспроизводства общественных отношений и систем жизнедеятельности. В новых условиях будет происходить посл ...
Просвещение в дагестане в первой половине хiх века
Русско-дагестанские связи восходят ко времени образования древнерусского государства. Их дальнейшее развитие происходило в условиях роста русского централизованного госу ...
Дефекты семейного воспитания
C того момента, как ребенок родился, и начал обживаться в мире, он начал обучаться. Обучаясь, ребенок постоянно воспитывается. Процесс воспитания направлен на формирование социальных качеств личности, на создание и расширение круга ее отношений к окружающему миру - к обществу, к людям, к самому себе. Чем шире, разнообразнее и глубже система отношений личности к различным сторонам жизни, тем богаче ее собственный духовный мир.
Самое интересное
- Главная
- Обучение
- Мотивация
- Экологическое воспитание
- Педагогический процесс
- Фольклор как средство воспитания
- Нарушение интеллекта у детей
- Карта сайта

