
Как AR Book совершенствует учебный процесс
AR Book — это прогрессивная система, которая воплощает самые современные технологии в сфере образования, внося радикальные изменения в методы обучения и оценки благодаря виртуальной реальности.

Megogo запускает новый раздел — Образование
В нем собраны более 1000+ лекций онлайн-школ и институтов для детей и взрослых. Сейчас пользователям предлагаются четыре основные темы: IT, бизнес и креатив, Образование для детей, Английский язык и Саморазвитие.
Химическое равновесие и условия его смещения
если n > 1, то получается олеум (раствор SO3 в H2SO4)
если n = 1 , то получается моногидрат (98,3% H2SO4)
если n < 1, то получается разбавленная серная кислота
При выборе абсорбента и условий проведения стадии абсорбции необходимо обеспечить почти 100%-ное извлечение SO3 из газовой фазы. В качестве абсорбента нельзя использовать такие растворы, над поверхностью которых велико парциальное давление паров воды. В этом случае еще не растворенные молекулы SO3 будут реагировать с молекулами воды в газовой фазе с образованием паров серной кислоты и быстро конденсироваться в объеме с образованием мельчайших капель серной кислоты, диспергированных в инертной газовой среде, т.е. с образованием сернокислотного тумана:
SO3(г) + H2O(г) ® H2SO4(г) ® H2SO4(туман) ; Q > 0
Туман плохо улавливается в обычной абсорбционной аппаратуре и в основном уносится с отходящими газами в атмосферу. Оптимальным абсорбентом является 98,3%-ная серная кислота (моногидрат). Действительно, над этой кислотой практически нет ни паров воды, ни паров SO3. Протекающий при этом процесс можно условно описать уравнением реакции:
SO3 + nH2SO4 + H2O = (n+1) H2SO4
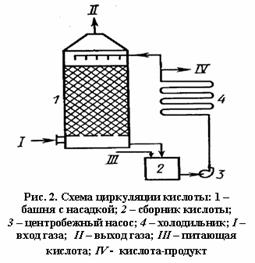
Для обеспечения высокой степени поглощения следует поддерживать в абсорбере концентрацию серной кислоты, близкую к 98,3%, а температуру ниже 100°С. Однако в процессе абсорбции SO3 происходит закрепление кислоты и в силу экзотермичности реакции увеличивается температура. Поэтому абсорбцию ведут так, чтобы концентрация H2SO4 при однократном прохождении абсорбера повышалась только на 1-1,5%, закрепившуюся серную кислоту разбавляют в сборнике до 98,3%, охлаждают в наружном холодильнике и вновь подают на абсорбцию, обеспечивая циркуляцию (рис. 2).
Тесты и задачи прикладного характера
Тесты типа «А»
1. Равновесие реакции 2Н2S (г.) + 3О2 (г.) = 2Н2О (г.) + 2SO2 (г.) при повышении давления смещается:
а) вправо; +
б) влево;
в) давление не влияет на равновесие.
2. Вещество, ускоряющее ход реакции, но при этом не расходующееся:
а) ингибитор;
б) катализатор; +
в) индикатор.
3. Повышение температуры в реакции 2Н2 + О2 = 2Н2О + Q кДж сказывается следующим образом:
а) не оказывает влияния;
б) смещает равновесие вправо;
в) смещает равновесие влево. +
4. Натрий энергичнее реагирует с водой, чем железо, поскольку:
а) натрий – газообразный элемент;
б) натрий – катализатор этой реакции;
в) натрий – ингибитор этой реакции;
г) натрий – щелочной металл. +
5. Реакцию, протекающую с поглощением тепла, называют:
экзотермической; 3) реакцией разложения;
реакцией соединения; 4) эндотермической. +
6. Реакцию, уравнение которой 2H2O + 2Na = 2NaOH + H2 + Q, относят к реакциям:
замещения, экзотермическим; +
разложения, экзотермическим;
присоединения, эндотермическим;
обмена, эндотермическим.
7. Реакцию, уравнение которой 3H2+N2 Û 2NH3 + Q, относят к реакциям:
1) обратимым, экзотермическим; +
2) необратимым, экзотермическим;
3) обратимым, эндотермическим;
4) необратимым, эндотермическим.
8. В ходе химических реакций тепловая энергия реакционной системы:
не изменяется;
поглощается;
выделяется;
может поглощаться или выделяться. +
9. С наибольшей скоростью при комнатной температуре протекает реакция взаимодействия:
углерода с кислородом;
железа с раствором уксусной кислоты;
железа с соляной кислотой;
растворов гидроксида натрия и серной кислоты. +
10. Какое из перечисленных условий не повлияет на смещение равновесия в системе: 2SO2 + O2 Û 2SО3 + Q?
введение катализатора; +
повышение давления;
повышение концентрации кислорода;
повышение температуры
11 – 12. Реакция, сопровождающаяся 11. выделением теплоты 12. поглощением теплоты называется
обратимой 3) прямой
эндотермической (12+) 4) экзотермической (11+)
13. При протекании химической реакции теплота
поглощается или выделяется +
обязательно поглощается
обязательно выделяется
условие недостаточно для однозначного ответа
14 - 15. Скорость реакции А(г) + В(г) ® . увеличивается при
14. 1) понижении концентрации А
повышении концентрации В +
охлаждении
понижении давления
15. 1) нагревании 3) добавлении инертного газа
2) повышение давления + 4) охлаждении
16. Состояние химического равновесия характеризуется
изменением химической природы продуктов
постоянством концентраций веществ +
повышением температуры
понижением давления
17. Состояние химического равновесия означает, что
все реагенты исчезли, полностью образовались продукты
все реагенты сохранились, полностью образовались продукты
часть реагентов исчезла, частично образовались продукты +
часть реагентов исчезла, но продукты не образовались
Более подробно о учебе:
Организация самостоятельной работы учащихся на уроках
экономики в школе
Самостоятельная работа представляет особый вид любой учебной деятельности учащихся, осуществляемой под руководством, но без непосредственного участия учителя. Самостояте ...
«Элитарные» и «трудовые» школы
Основная функция учреждений образования – обеспечение процесса воспроизводства общественных отношений и систем жизнедеятельности. В новых условиях будет происходить посл ...
Просвещение в дагестане в первой половине хiх века
Русско-дагестанские связи восходят ко времени образования древнерусского государства. Их дальнейшее развитие происходило в условиях роста русского централизованного госу ...
Дефекты семейного воспитания
C того момента, как ребенок родился, и начал обживаться в мире, он начал обучаться. Обучаясь, ребенок постоянно воспитывается. Процесс воспитания направлен на формирование социальных качеств личности, на создание и расширение круга ее отношений к окружающему миру - к обществу, к людям, к самому себе. Чем шире, разнообразнее и глубже система отношений личности к различным сторонам жизни, тем богаче ее собственный духовный мир.
Самое интересное
- Главная
- Обучение
- Мотивация
- Экологическое воспитание
- Педагогический процесс
- Фольклор как средство воспитания
- Нарушение интеллекта у детей
- Карта сайта

